Kongressbericht zum UroClub 2017
10.02.-11.02.2017 Mannheim
Anne Krampe-Scheidler
Einleitung
Mit seinem vielfältigen und interaktiven Programm auf hohem wissenschaftlichem Niveau hat sich der UroClub mittlerweile als hochkarätige Fortbildungsveranstaltung etabliert. In Mannheim hatten die knapp 300 Teilnehmer Gelegenheit, verschiedene urologische und uro-onkologische Operationen live zu verfolgen. Dazu gehörten unter anderem eine radikale Prostatektomie, Nierenteilresektionen und Nierenbeckenplastiken, aber auch kleinere Eingriffe wie die Fusionsbiopsie oder die Mikro-TESE. Im Mittelpunkt des Vortragteils standen neue Entwicklungen in der Diagnostik und Therapie des Prostatakarzinoms (PCa) und die Immunonkologie. Von den Daten leitete ein interdisziplinäres Tumorboard zur Entscheidungsfindung in der klinischen Praxis. Darüber hinaus wurden auf dem Symposium eine App zur Begleitung für Patienten mit PCa (PROSTANA) sowie die neu zugelassene, geschlechtsspezifisch dosierbare Therapie mit Desmopressin (NOCDURNA®) für Patienten mit nächtlicher Polyurie vorgestellt. Der von Prof. Kurt Miller, Berlin, und Prof. Maurice Stephan Michel, Mannheim, moderierte UroClub fand bereits zum vierten Mal statt.
Interaktive Live-Operationen: Behandlungsrealität in Deutschland
Die operativen Eingriffe wurden simultan aus drei Kliniken übertragen (Klinikum der Ludwig-Maximilians-Universität München, Universitätsklinikum Schleswig-Holstein, Campus Lübeck, Diakonissenkrankenhaus Dessau). Sie vermittelten einen Einblick in die Behandlungsrealität in Deutschland und demonstrierten die Bandbreite der derzeit eingesetzten Techniken. Prostatektomien (Abb. 1), Pyeloplastiken und Nierenteilresektionen wurden sowohl offen als auch laparoskopisch bzw. da-Vinci-assistiert durchgeführt. Im Rahmen der Blasendiagnostik und -therapie kamen Hybrid-Knife, NBI-Zystoskop und die photodynamische Diagnostik mit Hexvix® zum Einsatz. Beispielhaft für prothetische Eingriffe waren eine Sphinkter-OP und eine Penis-Prothese. Eingriffe an der Prostata erfolgten mit Holmium- (HoLEP) und Greenlight-Laser, darüber hinaus wurde eine transurethrale bipolare Resektion (TUR-P) demonstriert. Sogenannte kleine Eingriffe, die häufig auch ambulant durchgeführt werden, umfassten unter anderem Vasektomie, flexible Ureterorenoskopie (URS-Endoskopie), Fusionsbiopsie, die mikrochirurgische Entnahme von Hodengewebe (Mikro-TESE), die minimalinvasive perkutane Nephrolitholapaxie (Mini-PCNL) sowie die Ablation der Prostata mit dem Rezum™-System.
Abb. 1: Radikale Prostatektomie in der Urologischen Klinik und Poliklinik des Klinikums der Ludwig-Maximilians-Universität in München (Prof. Christian Stief und Team)
„Interaktivität“ war nicht nur ein Schlagwort, sondern zog sich erlebbar durch die gesamte Veranstaltung. So erläuterten die operierenden Ärzte während der Live-Schaltungen ihr Vorgehen und beantworteten die Fragen der Teilnehmer. Diese betrafen beispielweise die Indikation für den Einsatz des da-Vinci-Systems oder Möglichkeiten und Grenzen von Techniken wie HoLEP und Hybrid-Knife. Gleichzeitig wurde deutlich, welche Fortschritte durch Innovationen in der urologischen Diagnostik und Therapie erreicht worden sind. Die Fusionsbiopsie stelle „eine wirkliche Evolution in der Prostatadiagnostik“ dar, betonte Prof. Michel. Ebenso habe die flexible URS die Steintherapie in einer Weise verändert, wie dies „vor zehn Jahren kaum denkbar gewesen wäre“, so Prof. Miller.
Paradigmenwechsel beim metastasierten Prostatakarzinom
Neuerungen in der Therapie des metastasierten Prostatakarzinoms (mPCa) wurden von Prof. Miller vorgestellt. Entsprechend der aktualisierten S3-Leitlinie sollten Patienten in gutem Allgemeinzustand (ECOG 0-1) mit primär metastasiertem, kastrationssensiblem PCa zusätzlich zur Androgendeprivation (ADT) eine Chemotherapie mit Docetaxel erhalten.1 Die Empfehlung basiert auf den Ergebnissen randomisierter klinischer Studien, die für die kombinierte Therapie im Vergleich zur ADT allein einen signifikanten Überlebensvorteil zeigen konnten.2-7 Einschränkend wies der Urologe darauf hin, dass Patienten mit geringem Tumorvolumen nicht von der Kombination profitieren.3
Standardmäßig erfolgt die ADT mit LHRH-Agonisten oder -Antagonisten. Ein besonderes Augenmerk gilt Patienten mit vorbestehenden kardialen Erkrankungen, da die ADT bei ihnen mit einer erhöhten kardiovaskulären Mortalität assoziiert ist. Eine gepoolte Analyse von sechs randomisierten Phase-III-Studien mit insgesamt 2.328 PCa-Patienten mit kardiovaskulären Vorerkrankungen weist darauf hin, dass eine ADT mit dem LHRH-Antagonisten Degarelix (FIRMAGON®) im Vergleich zu den LHRH-Agonisten Leuprorelin und Goserelin das relative Risiko für kardiovaskuläre Ereignisse oder Tod um 56 % senken kann. Die absolute Risikoreduktion lag bei 8,2 %, daraus ergibt sich, dass zwölf Patienten mit Degarelix behandelt werden müssen, um ein kardiovaskuläres Ereignis oder Tod zu vermeiden.8 Zudem sprechen die Daten für ein längeres Gesamtüberleben mit Degarelix im Vergleich zu den LHRH-Agonisten Leuprorelin und Goserelin.9 Diese Daten haben bereits Eingang in die klinische Praxis gefunden, wie eine TED-Umfrage unter den UroClub-Teilnehmern zeigte (Abb. 2b). In der angelaufenen Phase-III-Studie PRONOUNCE soll nun geklärt werden, ob sie sich prospektiv bestätigen lassen (NCT02663908).
Auch bei metastasierten PCa-Patienten und hohem PSA-Ausgangswert (> 50 ng/ml) bietet Degarelix Vorteile und erscheint daher als geeigneter Kombinationspartner für die Chemotherapie (Abb. 2a). So zeigte sich in Studien, dass diese Patienten von Degarelix mit einem längeren PSA-progressionsfreien Überleben profitierten als von Leuprorelin bzw. Goserelin.10,11 Zudem hatten sie weniger Knochenschmerzen.11
Prof. Miller ging auch auf die Frage ein, ob der Primärtumor bei PCa-Patienten mit Oligometastasierung behandelt werden soll. Retrospektive Analysen lieferten Anhaltspunkte, dass eine radikale Prostatektomie oder Bestrahlung des Primarius einen Vorteil haben könnte. Weitere Ergebnisse aus prospektiv randomisierten Studien müssen abgewartet werden.
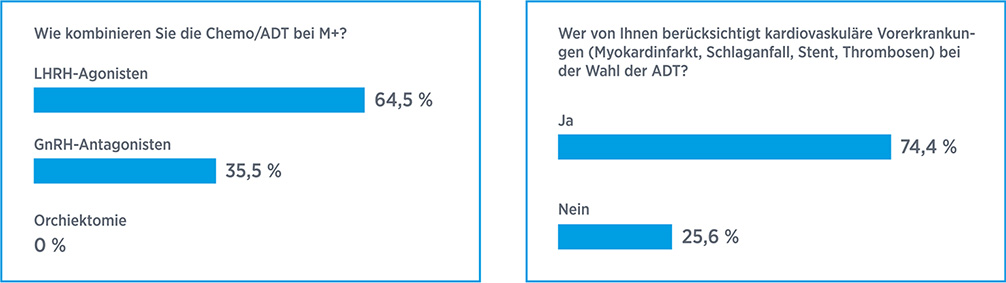
Abb. 2a: Mehr als ein Drittel der befragten Teilnehmer des UroClubs kombiniert die Chemotherapie bei metastasierten Patienten mit Degarelix. Abb. 2b: Fast drei Viertel gaben an, bei der Wahl der ADT kardiovaskuläre Vorerkrankungen zu berücksichtigen.
Liganden des Prostata-spezifischen Membran-Antigens (PSMA) zur Diagnostik und Therapie des Prostatakarzinoms
Diagnostik und Therapie des PCa mittels PSMA-Liganden standen im Mittelpunkt des Vortrags von Prof. Uwe Haberkorn, Heidelberg. Eine Bildgebung mit sehr hohem Kontrast ermöglicht der neu entwickelte PET-Tracer 68Gallium-PSMA-11 (68Ga-PSMA-11). Wie der Nuklearmediziner erläuterte, bindet das kleine Molekül PSMA-11 hochspezifisch an PSMA, das auf der Oberfläche von PCa-Zellen überexprimiert wird. Verglichen mit der konventionellen Bildgebung erzielt die 68Ga-PSMA-II-PET/CT sowohl beim Lokalbefund als auch im Primär- und Rezidiv-Staging höhere Sensitivitäten und sehr gute Spezifitäten. Zudem detektiert die PET-CT mit 68Ga-PSMA-11 deutlich mehr Läsionen in der Rezidivsituation, insbesondere bei Patienten mit niedrigen PSA-Werten. Dies führt laut Prof. Haberkorn zu Anpassungen der Therapiekonzepte, berge aber auch die Gefahr von Überdiagnosen.12-14
Da die Liganden nach der Bindung an das PSMA noch im Tumor verbleiben, bietet sich diese Zielstruktur auch für eine Radioligandentherapie (RLT) an. Bevorzugt kommen hierbei kleine Moleküle zum Einsatz, an deren Entwicklung das Team aus dem Deutschen Krebsforschungszentrum und der Universitätsklinik Heidelberg maßgeblichen Anteil hat. Die Therapie mit einem 131Iod markierten PSMA-Liganden führte bei zwei Dritteln von austherapierten PCa-Patienten zu einem Abfall des PSA-Wertes, einer Lebensverlängerung und einer Schmerzreduktion bei Knochenmetastasen.15 Seit 2014 wird ein Ligand genutzt, der die Verwendung der Betastrahler 90Yttrium und 177Lutetium (Lu) sowie des Alphastrahlers 225Actinium (Ac) erlaubt. Sowohl für den 177Lu- als auch den 225Ac-markierten Liganden zeigte sich ein gutes PSA-Ansprechen, jedoch war 225Ac mit einer ausgeprägten Xerostomie assoziiert.
Derzeit sei die PSMA-basierte RLT experimentell und werde nur bei Patienten im Endstadium angewendet, so Prof. Haberkorn. In Hinblick auf einen potenziellen Einsatz in früheren Stadien erläuterte der Experte, dass theoretisch ein erhöhtes Risiko für Leukämie und nach längerer Behandlungsdauer auch für Nierenschäden bestehe. Zudem sei die PSMA-Expression in kastrationsresistenten Tumoren höher, die sich daher eher für die RLT eignen. Beim Einsatz der aggressiveren Therapie mit 225Ac spielen die Lebenserwartung und die Lebensqualität eine wichtige Rolle.
Stellenwert des MRT in der Diagnostik des Prostatakarzinoms
Anknüpfend an die gezeigte Fusionsbiopsie der Prostata stellte Prof. Miller aktuelle Daten zum Stellenwert des MRT vor. Bei Patienten nach negativer systematischer Biopsie (Sekundärdiagnostik) kann das Verfahren entsprechend der aktualisierten S3-Leitlinie bereits angewendet werden.1 In der Primärdiagnostik (vor Biopsie) ist das MRT derzeit noch nicht in der S3-Leitlinie aufgeführt, allerdings steht die Aktualisierung dieses Kapitels noch an. Durch den negativen Vorhersagewert des MRT von etwa 90 % kann einem Teil der Patienten eine weitere Biopsie erspart werden. Die Detektionsraten liegen zwischen 60 % (PIRADS 4) und über 80 % (PIRADS 5) und sind von der Erfahrung des Untersuchers und möglicherweise von der verwendeten Technik abhängig.16,17 „Wenn man das MRT in der Primärdiagnostik einsetzt, gehört es zur Früherkennung, und diese wird dadurch besser“, so die Einschätzung des Experten. Auch bei Patienten, die für eine aktive Überwachung in Frage kommen, kann das MRT eine bessere Risikoabschätzung liefern, da PCa mit höherem Gleason-Score im MRT besser detektiert werden.18,19 Inwieweit das Verfahren in diesem Setting die Notwendigkeit von Folgebiopsien reduzieren kann, ist noch nicht geklärt.
Ausblick: Immuntherapien in der Urologie
Große Hoffnungen sind mit den neuen spezifischen Immuntherapien in der Onkologie verknüpft. Prof. Axel Merseburger, Lübeck, erläuterte, dass viele Karzinome Immunproteine exprimieren können, die eine Immunantwort des körpereigenen Immunsystems auf die Karzinogenese verhindern. Mithilfe sogenannter Checkpoint-Inhibitoren gelingt es, die vom Tumor induzierte Immunbremse wieder zu aktivieren. Je höher die Mutationsrate im Tumor, desto besser sprechen Tumoren auf eine Immuntherapie an. Während das PCa eher eine geringe Mutationslast aufweist, handelt es sich bei Nieren- und Blasenkarzinomen um immunogene Tumoren. Bereits im letzten Jahr wurde der Checkpoint-Inhibitor Nivolumab zur Therapie des fortgeschrittenen Nierenzellkarzinoms (RCC) bereits zugelassen.20 Die Zulassung weiterer Immuntherapien beim RCC und beim Urothelkarzinom wird absehbar erwartet. Auch beim metastasierten kastrationsrefraktären PCa (mCRPC) läuft eine größere Studie, die den PD-1-Inhibitor Pembrolizumab prüft. Prof. Merseburger betonte, dass sich die Immuntherapien nicht nur durch ihre Wirksamkeit, sondern auch durch eine gute Verträglichkeit auszeichneten. „Die Krebsimmuntherapie bildet mittlerweile die fünfte Säule der Tumortherapie. In zwei bis drei Jahren wird sich die Therapie des fortgeschrittenen metastasierten Urothelkarzinoms komplett gewandelt haben“, so die Prognose des Urologen.
Referenzen
1 Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms. AWMF Registernummer: 043/022OL, http://leitlinienprogramm-onkologie.de/Prostatakarzinom.58.0.html (Zugriff am: 20.02.2017)
2 Sweeney C et al. J Clin Oncol 32;2014(suppl;abstr LBA2)
3 Sweeny C et al. ESMO 2016; abstr. 720PD
4 Gravis G et al. J Clin Oncol 33;2015(suppl 7; abstr 140)
5 James ND et al. J Clin Oncol 33;2015(suppl; abstr 5001)
6 Tannock I. ASCO 2015 (Presentation)
7 Engel T et al. PLoS One. 2016; 11(6): e0157660
8 Albertsen PC et al. Eur Urol. 2014 Mar;65(3):565-73
9 Klotz L et al. Eur Urol. 2014 Dec;66(6):1101-8
10 Tombal B et al. Eur Urol. 2010 May;57(5):836-42
11 Tombal B et al. Eur Urol Supp. 2012;11(5):228
12 Afshar-Oromieh A et al. Eur J Nucl Med Mol Imaging. 2015 Feb;42(2):197-209
13 Eiber M et al. J Nucl Med. 2015 May;56(5):668-74
14 Morigi JJ et al. J Nucl Med 2015 August;56(8):1185-1190
15 Zechmann CM et al. Eur J Nucl Med Mol Imaging. 2014 Jul;41(7):1280-92
16 Pokorny MR et al. Eur Urol. 2014 Jul;66(1):22-9
17 Ahmed HU et al. Lancet. 2017 Jan 19. pii: S0140-6736(16)32401-1
18 Moore CM et al. Eur Urol. 2013 Jan;63(1):125-40
19 Da Rosa MR et al. J Magn Reson Imaging. 2015 Jan;41(1):220-5
20Motzer RJ et al. N Engl J Med 2015; 373(19):1803-1813











